







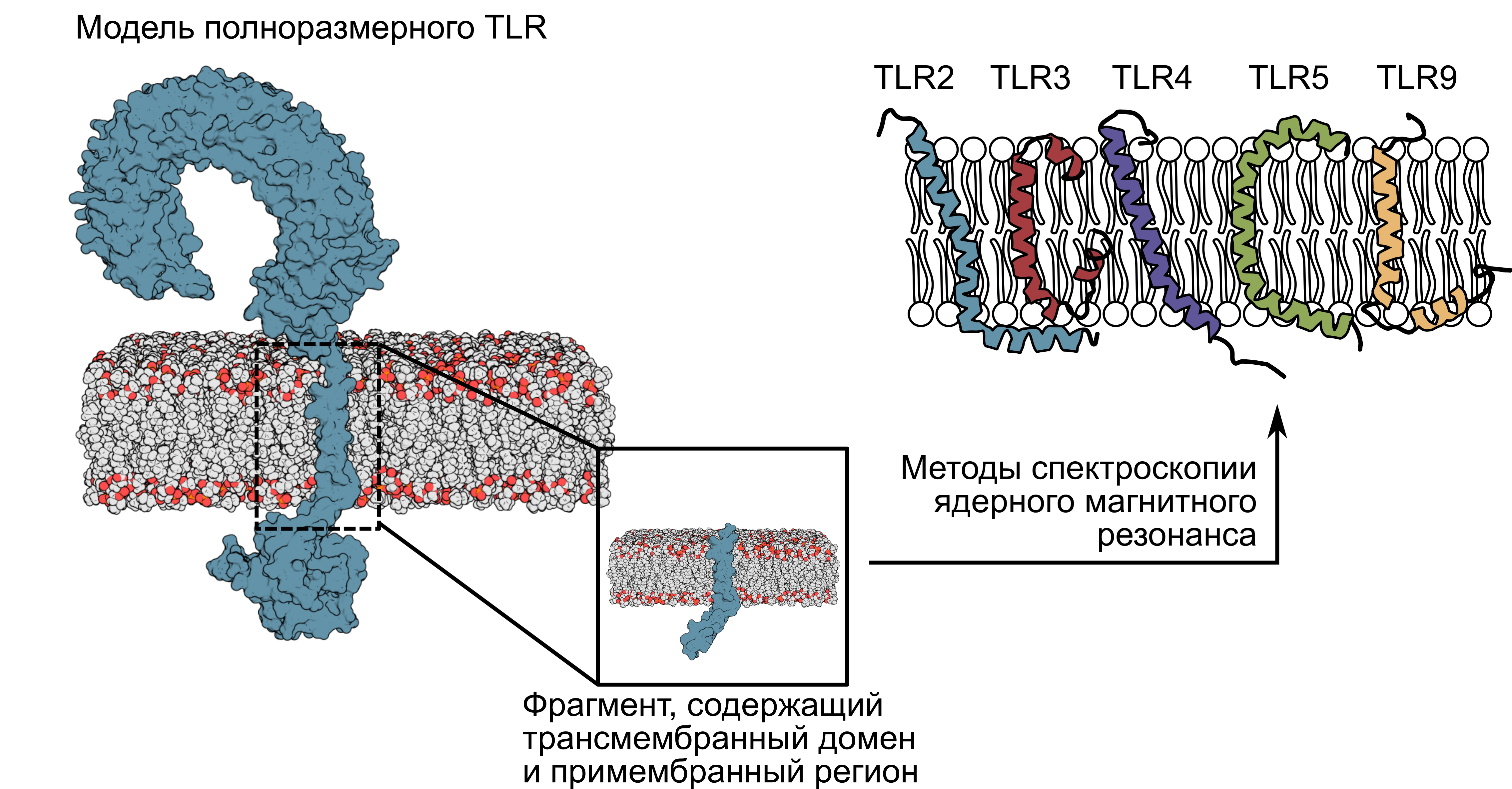
Описанные структуры мембранных фрагментов толл-подобных рецепторов всех пяти подсемейств. Источник: Федор Корнилов
Ученые получили трехмерные структуры мембранных «шей» всех четырех рецепторов. Так им удалось обнаружить ранее неизвестный «позвонок» с внутренней, цитоплазматической стороны. Он представляет собой небольшую ɑ-спираль из цепочки аминокислот, погруженную в мембрану. Далее авторы проанализировали ее последовательность и поняли, что она очень консервативна.«Консервативность говорит о том, что какой-то участок белка в определенный момент оказался “совершенным” и важным в своих функциях настолько, что в дальнейшем практически не изменялся. Найденная ɑ-спираль оказалась сопоставима по консервативности с остатками внутриклеточного домена, который необходим для запуска сигнального каскада. Примечательно, что ее окружение в рецепторе оказалось не столь постоянным», — рассказывает первый автор статьи и исполнитель проекта, поддержанного РНФ, Федор Корнилов, младший научный сотрудник лаборатории биомолекулярной ЯМР-спектроскопии ИБХ РАН.Чтобы понять, чем же найденная спираль столь значима, ученые искусственно внесли в нее мутации, а затем наблюдали, что будет с измененными клетками. Однозначного ответа такие эксперименты не дали. Так, в последовательности аминокислотных остатков TLR2 оказались «закодированы» важные взаимодействия, необходимые для работы комплекса, тогда как мутации в примембранном регионе TLR1 не оказывают влияние на его работу.
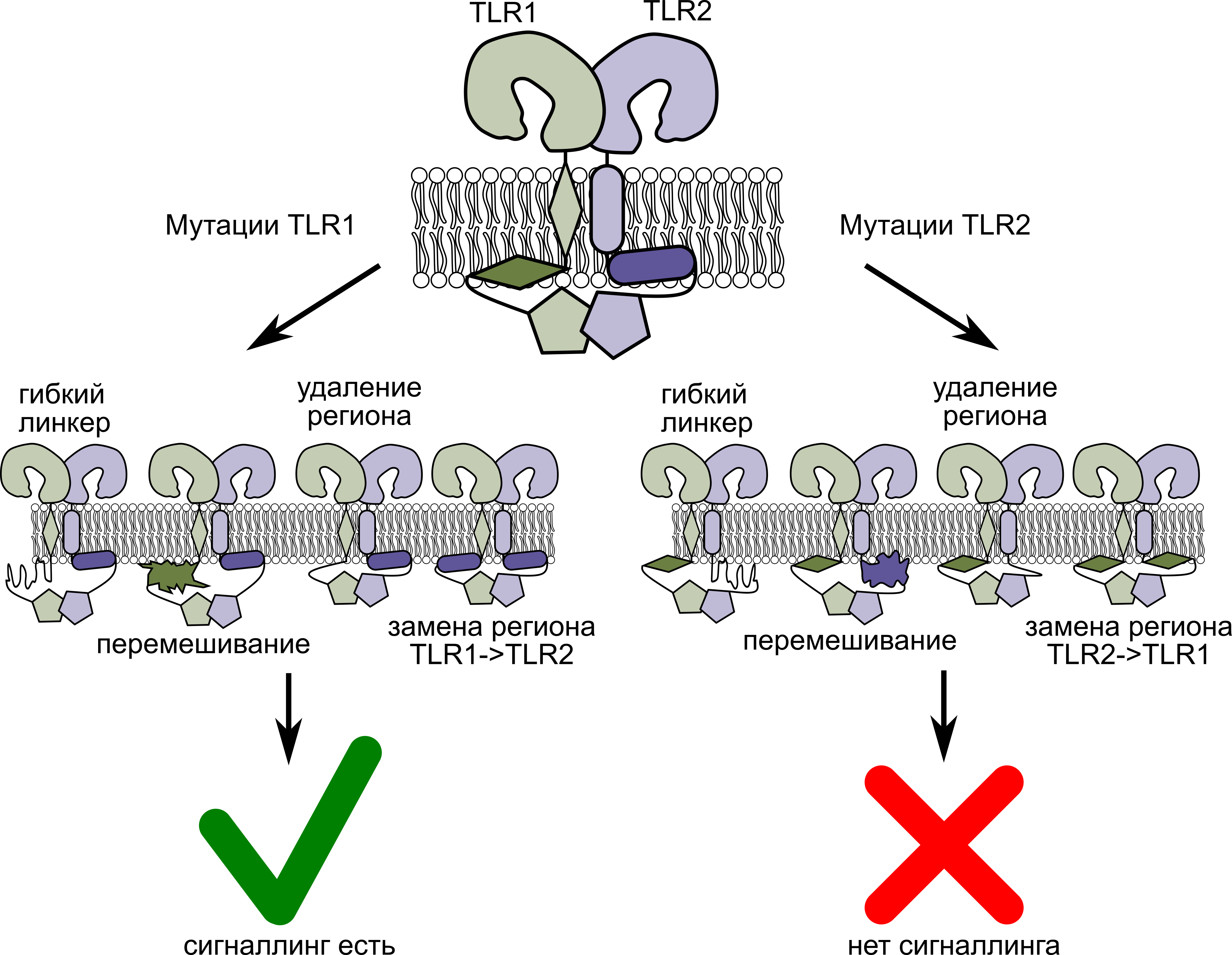
Влияние мутаций в мембранных фрагментах TLR1 и TLR2 на их сигнальные функции. Источник: Федор Корнилов
«Роль того или иного примембранного региона, по-видимому, зависит от конкретного контекста или запускаемого сигнального каскада — в дальнейшем мы планируем подробнее изучить этот вопрос. Но уже сейчас наше исследование закрыло большое белое пятно в структурной биологии толл-подобных рецепторов: считая ранее изученный нами TLR4, теперь для всех пяти подсемейств человеческих рецепторов известно строение мембранных доменов. На основании полученных данных можно будет заниматься компьютерным дизайном новых лекарств от онкологических и аутоиммунных заболеваний, нацеленных на толл-подобные рецепторы», — подводит итог руководитель проекта, поддержанного РНФ, Константин Минеев, доктор химических наук, ведущий научный сотрудник ИБХ РАН.Если вы хотите стать героем публикации и рассказать о своем исследовании, заполните форму на сайте РНФ

