«Известно, что причиной кардиологических заболеваний является рост стенозных бляшек, которые перекрывают кровоток в сосудах. Если бляшка перекрывает кровоток критическим образом, то есть площадь просвета становится меньше допустимого, то могут начаться необратимые последствия, и человека надо спасать операционным способом. Но исследования также показали, что, если провести операцию по стентированию раньше, чем бляшка вырастет до критического размера, это приведет к определенным рискам для организма. Наша идея заключается в том, чтобы контролировать степень перекрытия кровеносного сосуда и точно определять необходимое для операции время», — рассказывает профессор кафедры теоретической и математической физики УрФУ Андрей Зубарев.
На первом этапе проекта ученые работают над созданием максимально достоверной модели. При ее составлении они использовали реальные результаты исследования инвазивной коронарной ангиографии пациентов с ишемической болезнью сердца. Таким образом, им удалось смоделировать поток крови в условиях, максимально приближенных к реальной медицинской диагностике.
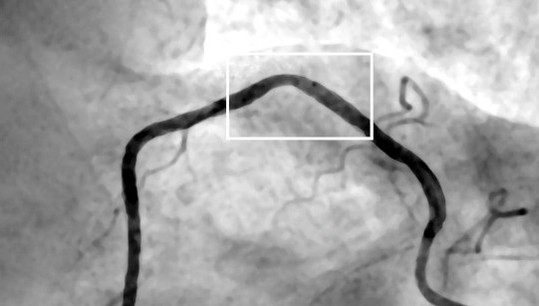
«На основе данных инвазивной коронарной ангиографии мы разработали трехмерную геометрическую модель участка артерии со стенозом. Используя данные о пульсации давления на входе в исследуемый участок артерии, мы провели гемодинамическое моделирование и получили результаты течения крови для полного кардиоцикла. Эти результаты показали, что за стенозом формируется низкоскоростной вихревой поток, а также возникает область высоковязкой крови, где вязкость увеличивается до двух раз», — поясняет младший научный сотрудник лаборатории многомасштабного математического моделирования УрФУ Илья Стародумов.
Кроме того, по его словам, из-за влияния стенок артерий поток становится значительно асимметричным. Это позволяет предположить, что альтернативы трехмерному моделированию для исследования сложных участков реальных сосудов нет.
«Моделирование артерии после предполагаемой реваскуляризации показывает отсутствие вихря и существенно более равномерные потоки в рассматриваемой области, а скорость потока при этом замедляется до 30%. Таким образом, гемодинамика в области стеноза может значительно отличаться от обычной динамики крови в здоровых участках артерии», — поясняет Илья Стародумов.
Следующий шаг — запустить в кровоток магнитные наночастицы диаметром 15–20 нанометров, которые позволят «визуализировать» процессы в сосудах. Идея вводить магнитные частицы принадлежит профессору Уральского государственного медицинского университета Феликсу Бляхману.
«Это будет магнетит. Он хорош тем, что с биологической точки зрения интактен: не вызывает воспалений и других реакции у организма. Выводится естественным способом. Что немаловажно с практической точки зрения — он относительно недорогой. И технологии изготовления наноразмерных частиц из магнетита давно хорошо отработаны, — говорит Андрей Зубарев. — По изменению отклика магнитных частиц можно судить об изменении скорости течения жидкости в конкретном месте. А это может указывать на степень сужения сосуда. Известно, что в месте сужения просвета скорость течения увеличивается пропорционально площади. То есть чем меньше площадь, тем выше скорость».
Исследовательский проект — масштабный. Работа состоит из теоретической и экспериментальной составляющей. Экспериментальную часть выполняют ученые Уральского государственного медицинского университета и Томского национального исследовательского медицинского центра. Они собирают и обрабатывают клинические данные. Вторая команда — из Уральского федерального университета — занимается теоретическим и вычислительным моделированием, численным моделированием и постобработкой полученных результатов. Здесь ученым УрФУ помогают коллеги — профессор из Манчестерского университета Сергей Федотов и ученый Института программных систем им. А. К. Айламазяна РАН Анатолий Цирлин.
«Наша цель — развивать модель: увеличивать размер расчетной области артерии, смотреть, как ведут себя сосуды. Задача сложная, так как у сосудов может быть бифуркация, бляшки могут располагаться различным образом — по несколько штук одновременно и перекрывать то место, где делятся. Необходимо также учитывать эластичную природу сосудов и то, что организм пытается прокачать кровь, растягивая стенки сосудов или пуская кровоток по другому каналу, — констатирует ведущий научный сотрудник лаборатории многомасштабного математического моделирования УрФУ Дмитрий Александров. — Живой организм — настолько сложная система, что можно моделировать ее очень долго, и мы сейчас в начале пути. В идеале хотелось бы говорить о персонифицированной медицине, когда диагностика коронарной артерии человека будет занимать порядка десяти секунд, но пока о практическом применении технологии говорить рано».
Проект получил два гранта РНФ. Первым грантом фонд поддержал экспериментальную группу (проект № 18-19-00090), которая под руководством Галины Курляндской проводит сбор и обработку клинических данных. Вторая команда, которая занимается теоретическими исследованиями, получила грант по проекту «Аномальный и нелинейный транспорт в гетерогенных и биологических системах» (№ 20-61-46013).