







Каждая клетка нашего тела является фабрикой по производству белков. Часть из них производится для внутреннего пользования, для поддержания жизни клетки, а другая часть «идет на экспорт». Все свойства белковых молекул (в том числе способность изумительно точно катализировать превращения других молекул в клетке) зависят от пространственной структуры белка, причем структура каждого белка уникальна.
Пространственная структура образуется уникальной укладкой белковой цепи, состоящей из разных аминокислотных остатков (бусинок разных цветов — рис. 1). Последовательность аминокислот в цепи белка определяется его геномом и синтезируется рибосомой, после чего пространственная структура цепи формируется «сама собой» в ходе сворачивания белковой цепи, которая выходит из рибосомы еще практически неупорядоченной.
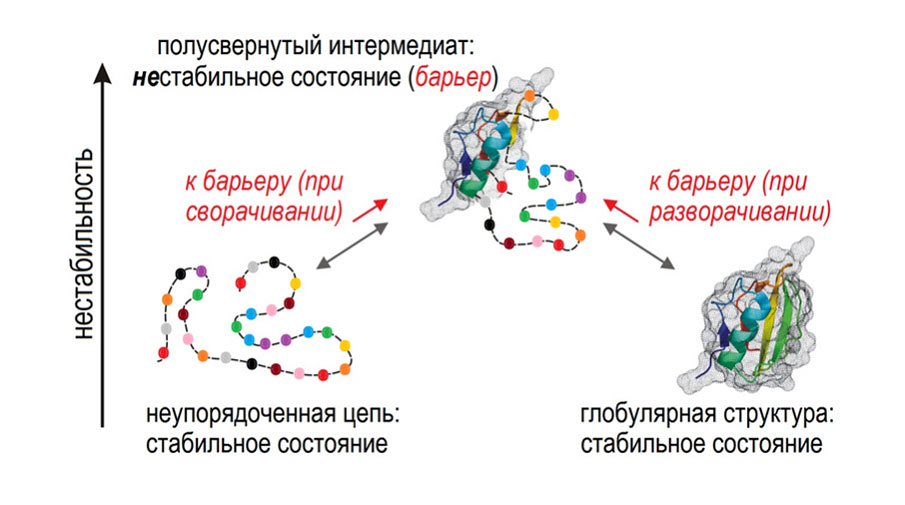
Образование уникальной белковой глобулы из неупорядоченной цепи (как и ее разворачивание) требует преодоления «барьера», имеющего вид нестабильной «полусвернутой» глобулы (рис.1). Источник: Алексей Финкельштейн.
Сворачивают эту цепь взаимодействия ее аминокислот, причем в одну и ту же структуру — как в организме, так и в пробирке. Разнообразие возможных укладок одной и той же цепи невообразимо велико. Но у заданной последовательности аминокислот есть, как правило, только одна стабильная («правильная») структура, которая и придает белку его уникальные свойства. Стабильна же она потому, что именно она обладает минимальной энергией.
Здесь перед учеными возник вопрос: как белковая цепь может спонтанно «найти» свою единственную стабильную структуру, если перебор колоссального числа всех вариантов (порядка 10100 для цепи из 100 аминокислотных остатков) занял бы времени больше, чем время жизни Вселенной. Этот «парадокс Левинталя», сформулированный полвека назад, был решен только теперь. Для его решения пришлось привлечь методы теоретической физики.

Кристаллы различных белков, выращенные на космической станции «Мир» и во время полетов шаттлов NASA. Источник: NASA Marshall Space Flight Center
Ученые из Института белка Российской академии наук (ИБ РАН) создали теорию скоростей образования пространственных структур молекул белка. Результаты работы были недавно опубликованы в журналах AtlasofScience, ChemPhysChem и «Биофизика». Работа поддержана грантом Российского научного фонда (РНФ).
В нашей работе представлена физическая теория, позволяющая оценить скорость этого процесса в зависимости от величины белков и сложности их устройства», — начинает рассказ о своей работе член-корреспондент РАН, доктор физико-математических наук, главный научный сотрудник Института белка РАН, руководитель гранта РНФ Алексей Финкельштейн.
«Давно известно, что белковая цепь приобретает свою уникальную структуру при одних условиях среды, а при других (например, при подкислении или подогреве раствора) эта структура разворачивается. На стыке этих условий уникальная структура белка находится в динамическом равновесии с развернутой формой его цепи, — продолжает он. — Процессы сворачивания и разворачивания там сосуществуют, их физика наиболее прозрачна. Поэтому мы сосредоточились именно на таких равновесных и квазиравновесных условиях — в отличие от других исследователей, которые как будто резонно (но ошибочно, как оказалось) полагали, что путь к тайне сворачивания белка надо искать там, где оно протекает наиболее быстро».
«Первый подход к проблеме Левинталя был разработан нами давно, — рассказывает Алексей Финкельштейн, — и заключался в следующем: так как теоретически проследить путь сворачивания белка очень трудно, нужно изучать процесс его разворачивания. Звучит парадоксально, но в физике существует принцип «детального равновесия», который гласит: любой процесс в равновесной системе протекает по тому же пути и с той же скоростью, что и обратный ему. И так как в динамическом равновесии скорости сворачивания и разворачивания одинаковы, мы рассмотрели более простой процесс разворачивания белка (ведь разломать проще, чем сделать) и охарактеризовали тот «барьер» (см. картинку 1), нестабильность которого определяет скорость процесса».
Следуя принципу детального равновесия, ученые из Института белка РАН оценили и «сверху», и «снизу» скорость сворачивания белков — как больших, так и маленьких, как с простой, так и со сложной укладкой цепи. Небольшие и просто устроенные белки сворачиваются быстрее (оценка скорости «сверху»), а большие и/или сложно устроенные — медленнее (оценка «снизу»). Значения всех остальных возможных скоростей сворачивания заключены между ними.
И работы продолжались: на этот раз учеными из ИБ РАН были произведены расчеты сложности сворачивания белка. Давно известно, что взаимодействия в белках связаны в основном с так называемыми вторичными структурами. Вторичные структуры — это стандартные, довольно крупные локальные «строительные блоки» белковой структуры, определяемые в основном локальными аминокислотными последовательностями в них. Количество возможных вариантов укладки таких блоков в структуру свернутого белка можно подсчитать, что и было сделано учеными из ИБ РАН. Число таких вариантов огромно — порядка 1010 (но далеко не 10100!) для цепи из порядка 100 аминокислот, и белковая цепь может, согласно теоретическим оценкам, «просканировать» их за минуты или — для более длинных цепей — за часы. Так была получена самая верхняя оценка времени сворачивания белка.
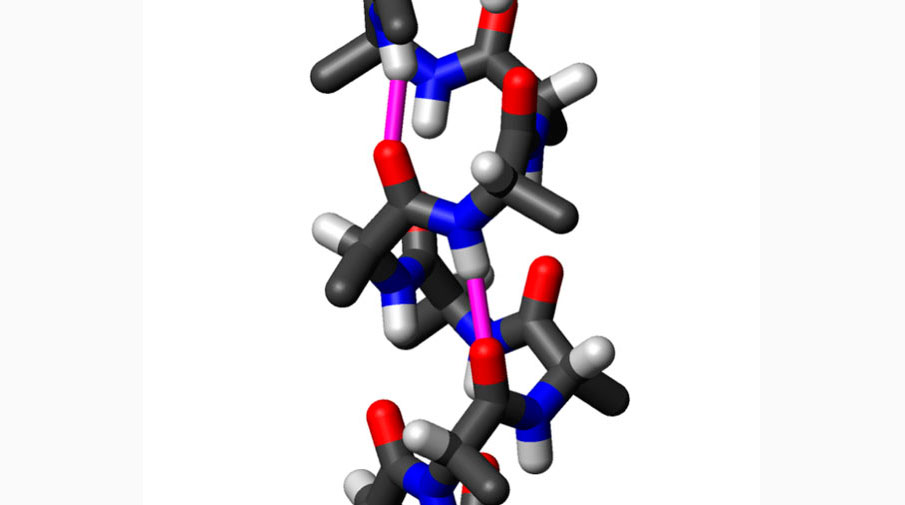
Регулярная вторичная структура – альфа-спираль. Источник: WillowW
Результаты, полученные двумя способами (т.е. при анализе и разворачивания, и сворачивания белка), сходятся и подтверждают друг друга.
«Наша работа имеет фундаментальное значение для конструирования в будущем новых белков для нужд фармакологии, биоинженерии, нанотехнологии, — заключает Алексей Финкельштейн.
«Что изменилось после получения гранта РНФ? Появилась возможность закупить новое современное оборудование и реактивы для работы (ведь наша лаборатория в основном экспериментальная, хотя я здесь рассказал только о нашей теоретической работе). Но главное: грант РНФ позволил специалистам заниматься наукой, а не искать подработку на стороне или в дальних краях», — говорит Алексей Финкельштейн.

