Одной из наиболее серьезных угроз современности
стала антибиотикорезистентность патогенных бактерий, то есть их невосприимчивость к действию противомикробных лекарств. Такие «суперинфекции» ежегодно приводят к гибели более 700 тысяч человек во всем мире; по
прогнозам, к середине XXI века эта цифра превысит показатели смертности от рака и достигнет более чем 10 миллионов смертей в год.
«Если сегодня весь мир знает о том, что такое новый коронавирус, то завтра каждый житель Земли будет знать, что такое карбапенем-устойчивая клебсиелла, вызывающая кишечные расстройства, пневмонию, сепсис и другие заболевания, или синегнойная палочка — возбудитель так называемых госпитальных инфекций. Группа антибиотиков карбанепемов относится к лекарствам резерва, которые применяются для терапии самых тяжелых бактериальных болезней, однако, к сожалению, микроорганизмы вырабатывают устойчивость и к ним. Нужен совершенно новый подход к борьбе с резистентностью, и в своей новой работе я предлагаю один из вариантов», — рассказывает руководитель проекта по гранту РНФ Альберт Болатчиев, кандидат медицинских наук, сотрудник Ставропольского государственного медицинского университета (Ставрополь).
Одним из потенциальных источников новых препаратов могут стать короткие — всего в несколько аминокислотных остатков — антимикробные пептиды, которые вырабатывают живые организмы для борьбы с разными инфекциями и опухолями. Благодаря своему положительному заряду, они связываются с отрицательно заряженными мембранами патогена, нарушая их целостность, а также проникая внутрь и негативно влияя на синтез РНК и ДНК.
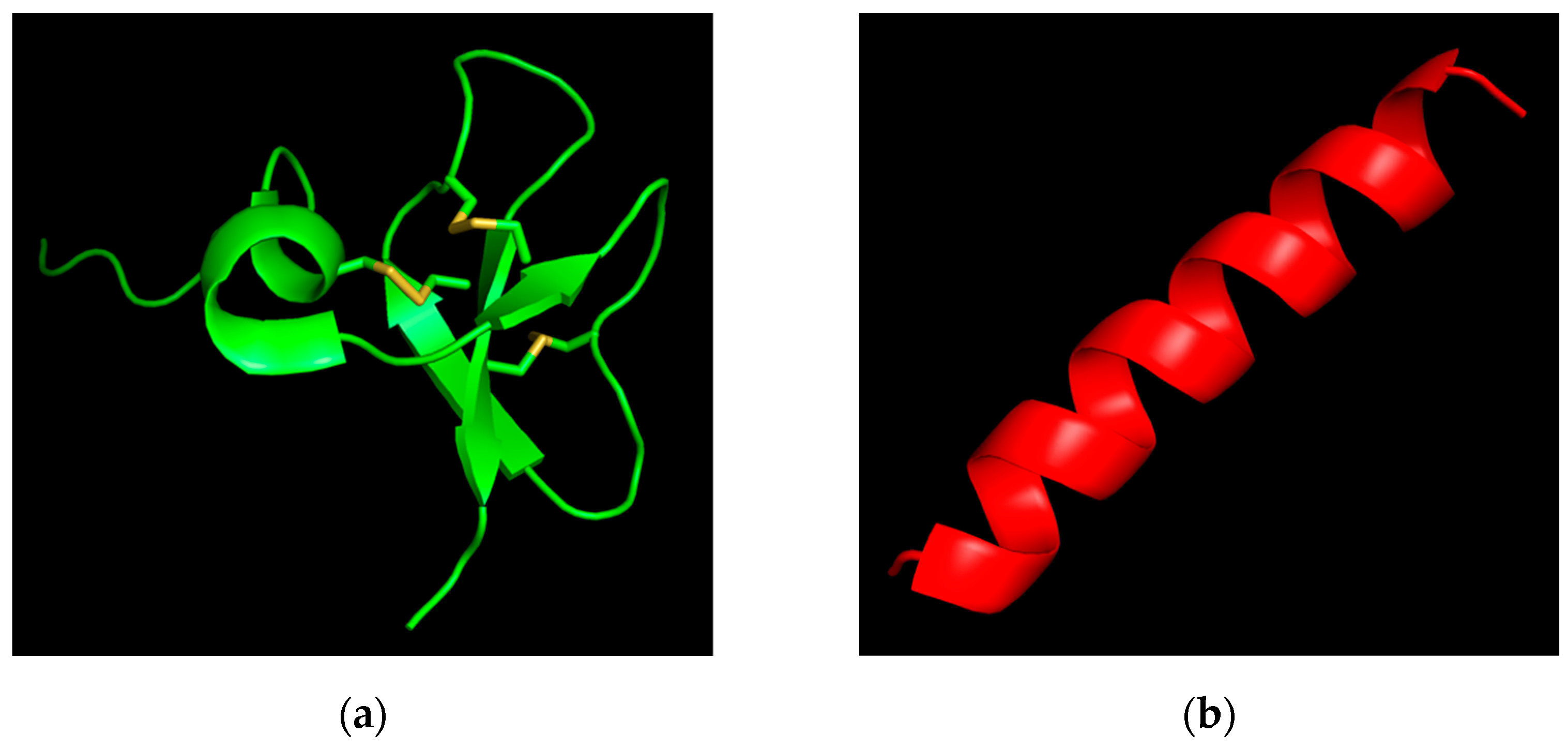
Альберт Болатчиев исследовал активность двух таких пептидов — бета-дефензина-3 (hBD-3) человека и эпинецидина-1 (Epi-1) оранжево-пятнистого морского окуня, — а также получил трехмерные модели молекул при помощи искусственного интеллекта, а именно алгоритма
AlphaFold.
Эксперименты на метициллин-устойчивых золотистых стафилококках (вызывают пневмонию и сепсис) и карбапенем-устойчивых штаммах синегнойной палочки, клебсиеллы и ацинетобактера (вызывает менингиты и сепсисы с абсцессами) показали эффективность как самих пептидов, так и их сочетания с антибиотиками — в этом случае их требовалось втрое меньше, что особенно полезно с учетом дороговизны. Автор опробовал такой подход в лечении сепсиса у мышей, вызванного инъекцией летальных доз устойчивых к карбапенемам бактерий — клебсиеллы и синегнойной палочки. Предсказуемо, что без лечения умирают все инфицированные животные. В обоих экспериментах терапия одним карбапенемом была полностью неэффективна.
Для инфекции, вызванной клебсиеллой, лечение одним hBD-3 обеспечило выживаемость 63,3% животных, совместное применение сразу двух пептидов было более действенным (70%). Что самое интересное, использование совершенно неэффективного карбапенема совместно с hBD-3 увеличило выживаемость до 83,7%. Это может быть связано с тем, что антимикробный пептид hBD-3 каким-то образом «превращает» карбапенем-устойчивую бактерию в карбапенем-чувствительную.
«Внедрение антимикробных пептидов как замены антибиотикам осложняется их дороговизной. Предложенный в этой работе подход позволяет снизить стоимость нового препарата за счет комбинации. Кроме того, можно сделать осторожный вывод, что применение антимикробных пептидов способно вернуть чувствительность бактерий к классическим антибиотикам. Конечно, это предварительные выводы, и для их подтверждения необходимы дополнительные исследования. Мы пока не можем точно сказать, почему бактерии становятся более чувствительными к антибиотикам при совместном применении с антимикробными пептидами. Пептиды помимо прямого повреждающего действия на бактерии обладают различным спектром иммуномодулирующих эффектов, которые можно проверить только в экспериментах на животных. В будущем мы планируем более детально изучить природу этого феномена», — рассказывает Альберт Болатчиев.
В случае инфекции, вызванной синегнойной палочкой, hBD-3 и карбапенем и сам по себе hBD-3 оказались одинаково эффективны (выживаемость более 60%). При добавлении к hBD-3 пептида Epi-1 результат резко улучшается до 86,7%.
«Второй важный вывод из проведенного исследования состоит в том, что антимикробные пептиды могут усиливать эффективность друг друга при их совместном применении. Это говорит о том, в будущем мы сможем создавать препараты, основанные на комбинации сразу нескольких пептидов в одном», — отмечает автор работы.