Цистеиновые протеазы, или каспазы, — ключевые ферменты, которые участвуют в гибели клеток (апоптозе) и обеспечивают протекание этого процесса. Каспазы последовательно разрезают друг друга, что приводит к их активации, и массово разрушают клеточные компоненты и структуры. Процесс апоптотической клеточной гибели является неотъемлемым физиологическим процессом, благодаря которому возможно правильное образование тканей в многоклеточных организмах, а также удаление поврежденных, мутантных и злокачественных клеток. Одна из самых консервативных цистеиновых протеаз, каспаза-2, которая участвует непосредственно в запуске апоптотической гибели, стала объектом исследования авторов статьи.
«Пару лет назад, используя биоинформатический подход, молодые сотрудники лаборатории показали, каким образом посттрансляционные изменения в структуре каспаз могут влиять на регуляцию апоптоза, — рассказывает Борис Животовский, доктор биологических наук, заведующий лабораторией исследований механизмов апоптоза факультета фундаментальной медицины МГУ. — Сотрудница лаборатории Гелина Копеина среди первых получила грант Президентской программы РНФ, одной из основных задач которого было развитие данного направления».
Авторы сосредоточились на исследовании посттрансляционных изменений —происходящих уже после синтеза белка рибосомами — каспазы-2 в опухолевых клетках. Используя различные биоинформатические модели, они спрогнозировали, фосфорилирование каких именно участков фермента может повлиять на его работу. Фосфорилирование — это присоединение остатка фосфорной кислоты, играющее важную роль практически во всех клеточных процессах.
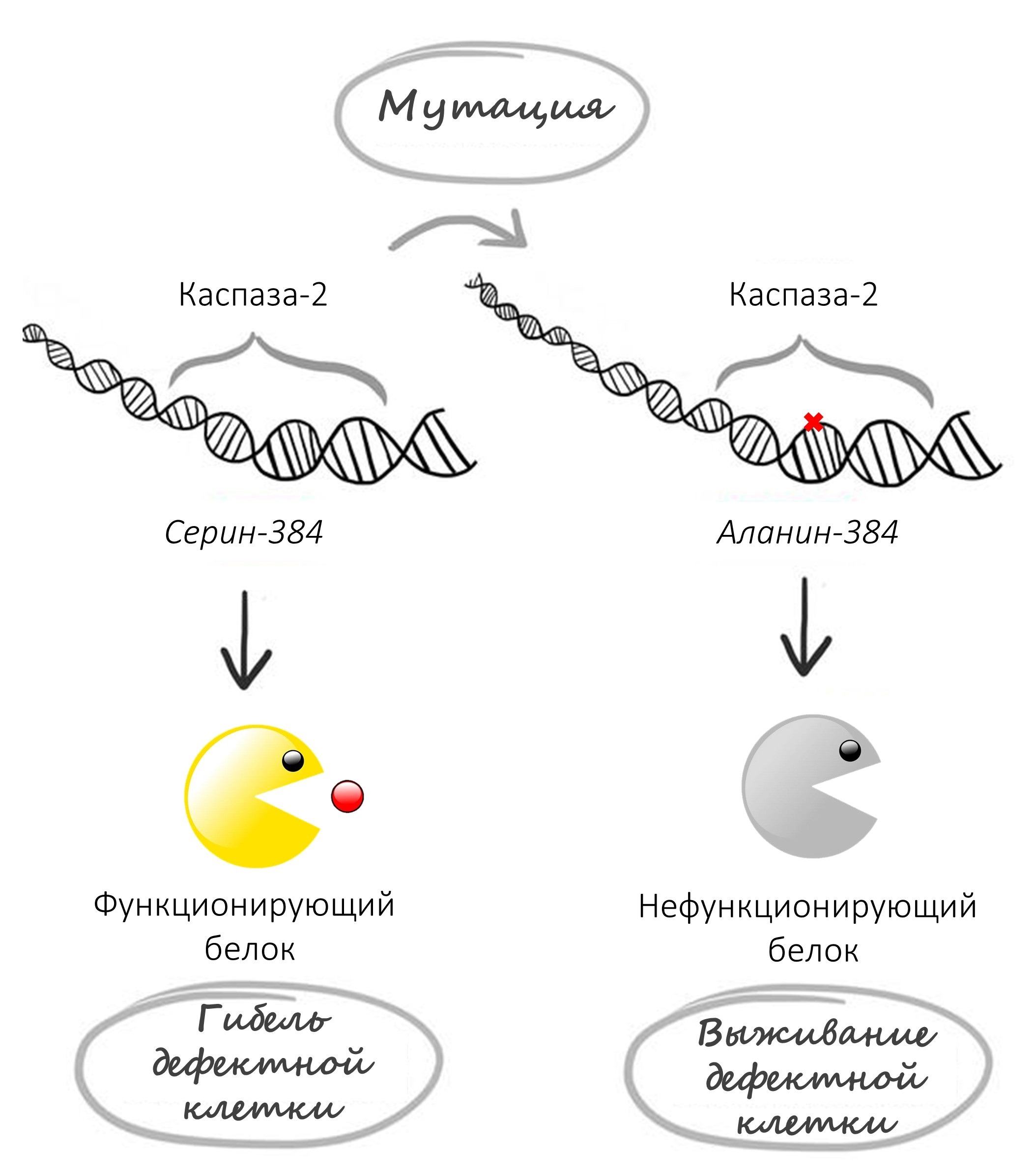
«Вместе с выпускником МГУ Павлом Воликом создали мутантные формы каспазы-2, в которых предсказанные сайты фосфорилирования были заменены на немодифицируемые аналоги, то есть к ним нельзя было присоединить фосфат. Изучая биохимические особенности мутантных форм, мы установили, что одна из аминокислотных замен (Серин-384-Аланин, то есть серин в позиции 384 заменен на аланин) полностью подавляет работу фермента и предотвращает апоптотическую гибель клеток», — рассказывает один из авторов исследования Алексей Замараев, научный сотрудник лаборатории.
Такой эффект наблюдался в клетках различных типов опухолей. Совместно с коллегами из Института физико-химической биологии имени А. Н. Белозерского группа провела молекулярное моделирование замены остатка Серина-384 на Аланин. Выяснилось, что нарушение каталитической активности каспазы-2, вызванное мутацией, может проводить к нарушению местоположения другой аминокислоты — Аргинина-378. Правильное расположение Аргинина оказалось критически важным для распознавания каспазой-2 белковых субстратов и их последующего расщепления. Также исследователи проанализировали последовательности аминокислот других цистеиновых протеаз у различных животных. Оказалось, что эти остатки высоко консервативные и, вероятно, общие для других членов семейства. Авторы сделали вывод, что без них невозможна работа каспаз.
«Обнаруженные мутации имеются в раковых клетках пациентов с карциномой эндометрия и при аденокарциноме легкого. Таким образом, полученные результаты имеют важное значение для понимания регуляторных механизмов апоптотической гибели клеток и связанных с ним нарушений, а также для разработки новых эффективных противоопухолевых методов лечения», — заключает руководитель проекта Гелина Копеина, кандидат биологических наук, ведущий научный сотрудник лаборатории.