






Белки — это разнообразные молекулы со сложной структурой, которые выполняют различные клеточные и биохимические функции. Они работают в качестве «арматуры», молекулярных машин, ускоряют химические реакции, избирательно транспортируют «полезные грузы» по клетке и в целом совершенно необходимы живому организму. Уникальные свойства белков напрямую определяются структурой, а та, в свою очередь, закодирована в их последовательности — то есть цепочке следующих друг за другом аминокислот.
Изучая связь структуры и функции белков, биологи поняли, что вполне могут взять на себя работу эволюции и создавать новые белковые молекулы, целенаправленно меняя их последовательность. Для этого используют белковую инженерию, то есть модификацию природных белков с помощью мутаций, либо создают новые, полностью искусственные молекулы «с нуля» — это уже так называемый белковый дизайн.
Одним из самых значимых достижений в биологии последних лет стал AlphaFold — метод искусственного интеллекта, которой эффективно предсказывает трехмерную структуру белков исходя из последовательности. Однако для создания новых белков требуется решить обратную задачу — подобрать такую последовательность, которая самопроизвольно свернется в молекулу с нужной формой. Такие методы уже доступны — к примеру, ProteinMPNN, основанный на глубоком обучении — разновидности машинного обучения с использованием нейронных сетей.
«Благодаря развитию методов машинного обучения в последние два года в области инженерии белков происходит настоящая революция. Если ранее практически любой проект требовал экспериментальной проверки большого количества тестовых образцов (зачастую нескольких тысяч и больше), то сейчас стали доступны новые методы, которые позволяют создавать новые белки с улучшенными свойствами гораздо быстрее (и дешевле)», — поделился руководитель исследования Иван Гущин, заведующий лабораторией структурного анализа и инжиниринга мембранных систем МФТИ.
Однако до недавнего времени белковая инженерия плохо справлялась с созданием молекул, которые связывают небольшие соединения небелковой природы. Это, например, кофакторы, которые не состоят из аминокислот и относятся к различным группам химических веществ.
Вероятно, вскоре в распоряжении ученых окажутся новые методы, предназначенные специально для таких «сложных» белков. Однако авторы новой статьи решили этого не дожидаться и попробовали поменять связывающие кофакторы белки с помощью метода, предназначенного для «обыкновенных». Такой прямолинейный подход не гарантировал успеха, ведь мутации даже на значительном расстоянии вполне могли «сломать» белки — нарушить их функции.
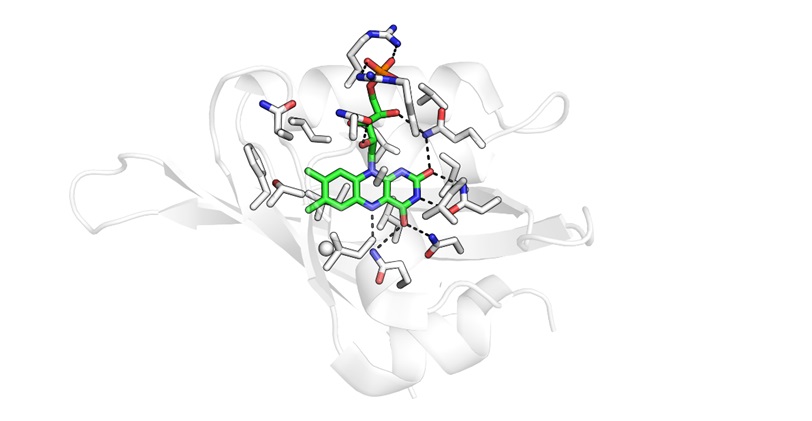
Источник иллюстрации: статья исследователей в журнале Protein Science
Объектом исследования стал белок CagFbFP, связывающий флавины — небольшие молекулы, необходимые для множества биологических реакций. Коллектив из МФТИ не впервые использует эту биомолекулу, исходно выделенную из растущей при высокой температуре бактерии Chloroflexus aggregans. Недавно ученым удалось внести мутации в последовательность CagFbFP, изменив спектры его флуоресценции, и установить механизмы такого «перекрашивания».
Биофизики учли, что мутации в расположенной вблизи кофактора части белка могут нарушить связывание молекул, флуоресценцию их комплекса и его стабильность. Поэтому они меняли только ту часть белка, которая отдалена от связывающего лиганд «кармана». Нейронные сети предложили заменить в общей сложности более половины (до 55–66%) аминокислот CagFbFP. Замены оказались довольно специфичными: они повлияли на распределение заряда на поверхности белка и склонность его молекул объединяться в пары (димеры). Тем не менее мутации не помешали новым флавинсвязывающим белкам сохранить ценные свойства. Авторы убедились в этом, синтезировав реальные белковые молекулы и изучив их физические свойства.
«Мы получили замечательный результат: из трех предсказанных искусственных конструкций, несмотря на большое количество изменений, все три оказались функциональны. Более того, одна значительно превзошла по свойствам исходный белок. Сейчас мы занимаемся проверкой применимости этого подхода к более сложным случаям, в том числе к используемым на практике ферментам», — отметил Иван Гущин.
Стоит отметить, что остроумный подход ученых использован впервые в мире. Однако параллельно работавшие над ним исследователи из MIT (Массачусетского технологического института, США), которые использовали другие белки, смогли опубликовать аналогичные результаты раньше. Хотя, если учесть время появления первых версий статей (препринтов) и подачу их в журналы, то первенство следует отдать именно команде из МФТИ.

